时至今日,阿尔茨海默症(Alzheimer’s disease, AD)已成为现代社会中人类健康的第四大杀手。截止2013年,全球范围内大约有四千万的患者,其中我国患者为一千万,居于世界首位。因此,寻找针对这个疾病的有效治疗手段刻不容缓。尽管AD的确切发病机制目前尚不清楚,但是近期的大量研究表明,β-淀粉样蛋白(β-amyloid peptide, Aβ)在脑内的过度表达、聚集进而沉淀形成淀粉样斑块是AD的一个关键病理事件。抑制Aβ的聚集是预防和治疗AD的重要策略,具有重要的应用前景。
本课题组们以Aβ 肽亲水区特有的带正电荷的氨基酸序列“组氨酸-组氨酸-谷氨酰胺-赖氨酸(HHQK)”为作用位点,这个序列最大的特点就是存在着两个连续的组氨酸。同时,很多过渡金属原子与组氨酸之间都存在着很强的螯合作用。如果可以在POMs 上修饰过渡金属原子,那么这类POMs 衍生物就可以增强对HHQK 区域的识别能力,从而增强了对Aβ 的识别能力。因此我们首先以POMs 中对Aβ 抑制能力最强且带负电荷的Dawson 型POM 为母体,在POM 表面分别修饰了不同的过渡金属原子,得到了一系列POM 衍生物(图1)。为了确定何种过渡金属取代可以增强POM 衍生物对HHQK 序列的识别能力,我们引入了在生物学中广泛使用的半理性筛选方法,利用本实验室已建立的高通量筛选体系对上述POM 衍生物进行筛选(图2),并对最终得到的优秀抑制剂进行了全面和系统的研究。实验结果证实修饰了不同的过渡金属原子的POM 衍生物确实可以同时加强其对Aβ 的HHQK 区域的识别能力(图3),同时增强对Aβ 的抑制效果(图4),其中最好的衍生物的对Aβ 的表观结合常数比未修饰时的POM 增强了约6.44 倍,半抑制浓度(IC50)比未修饰时降低了约4.5 倍。我们同时还利用了分子动力学模拟的方法证实了POM 与Aβ 之间的作用方式与作用位点(图5)。此外,该POM 衍生物对Aβ 寡聚体的形成和Aβ-heme复合物产生的过氧化物酶活力也都具备很好的抑制作用(图6,7)。该成果已发表于Nature Communications 杂志( Nat. Commun., 5:3422, doi:10.1038/ncomms4422, 2014)。该结果证实了本项目中提出的设想具备一定的科学性和可行性。
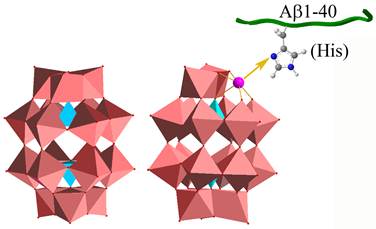
图1. POM和表面分别修饰了不同金属离子的POM衍生物的结构,以及POM衍生物与Aβ特异序列相互作用原理示意图。
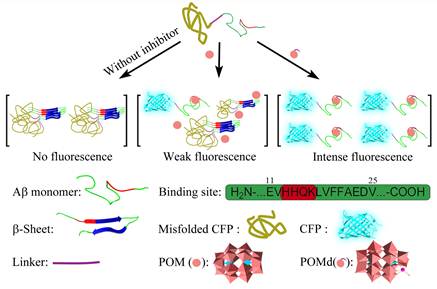
图2. 本实验室建立的Aβ抑制剂高通量筛选体系工作原理示意图。
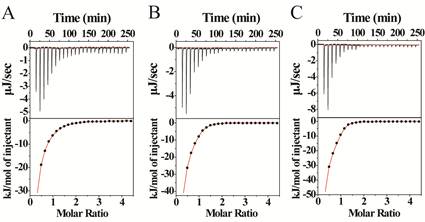
图3. 等温滴定量热法(ITC)测定POM/POM衍生物与Aβ 之间的结合常数。A:POM ;B:POM-Co;C:POM-Ni.
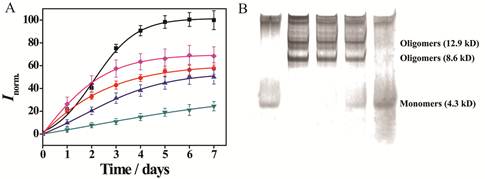
图4. POM衍生物对Aβ聚集具有更强的抑制能力. A) 利用ThT 荧光法监测Aβ的聚集情况。(■):单独Aβ;(▲):Aβ+POM;(●):Aβ+POM-Co;(▼):Aβ+POM-Ni;(◆):Aβ+POM+Ni2+. B) 利用native PAGE的方法监测Aβ的聚集情况。Lane 1: Aβ单体;Lane 2: Aβ纤维;Lane 3: Aβ+POM;Lane 4: Aβ+POM-Co;Lane 5: Aβ+POMds-Ni.
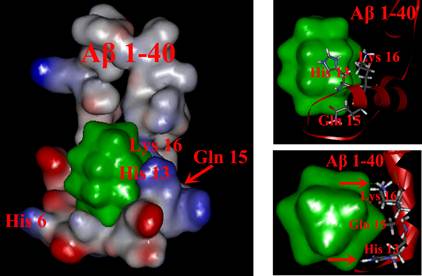
图5. 利用分子动力学模拟证实POM与Aβ 之间的作用方式与作用位点。

图6. 利用原子力显微镜(AFM)证实POM衍生物抑制了Aβ寡聚体的生成。A:Aβ单体;B:POM-Dawson;C:Aβ+Cu2+ 37 °C孵育24小时;D:Aβ+Cu2++POM 37 °C孵育24小时;E:Aβ+Cu2++POM-Co 37 °C孵育24小时;F:Aβ+Cu2++POM-Ni 37 °C孵育24小时。
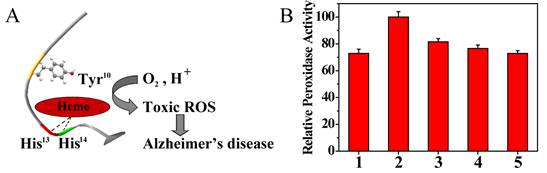
图7. POM衍生物抑制Aβ-heme复合物产生的过氧化物酶活力。(A) Aβ-heme复合物产生过氧化物酶活力示意图。(B) POM衍生物抑制Aβ-heme复合物产生的过氧化物酶活力。1) Heme; 2) Heme+Aβ; 3) Heme+Aβ+POM; 4) Heme+Aβ+POM-Co; 5) Heme+Aβ+POM-Ni.

